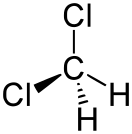
Дихлорметан
| Дихлорметан | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
дихлорметан | ||
| Сокращения | ДХМ | ||
| Традиционные названия | хлористый метилен, хлорид метилена, фреон 30, хладон 30 | ||
| Хим. формула | CH2Cl2 | ||
| Рац. формула | CH2Cl2 | ||
| Физические свойства | |||
| Состояние | подвижная прозрачная жидкость | ||
| Примеси | хлорметаны | ||
| Молярная масса | 84,9 г/моль | ||
| Плотность | 1,3266 г/см³ | ||
| Энергия ионизации | 11,32 ± 0,01 эВ[8][9] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −96,7 °C | ||
| • кипения | 40 °C | ||
| • вспышки | 14 °C | ||
| Пределы взрываемости | 13 ± 1 об.%[8] | ||
| Критическая точка | 245 | ||
| Энтальпия | |||
| • образования | −87,86 кДж/моль | ||
| Удельная теплота испарения | 336,4 Дж/кг | ||
| Давление пара | 0,566 бар [1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | (при 20 °C) 1,3 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,4242 | ||
| Структура | |||
| Дипольный момент | 5,3E−30 Кл·м[9] | ||
| Классификация | |||
| Рег. номер CAS | 75-09-2 | ||
| PubChem | 6344 | ||
| Рег. номер EINECS | 200-838-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA8050000 | ||
| ChEBI | 15767 | ||
| Номер ООН | 1593[2] | ||
| ChemSpider | 6104 | ||
| Безопасность | |||
| Предельная концентрация | 50 мг/м³[3] | ||
| ЛД50 | 1500 мг/кг (крысы, перорально[4] | ||
| Токсичность | Класс опасности[5] по ГОСТ 12.1.007: 4-й[6][7] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Дихлормета́н (метилѐнхлори́д, хлóристый метилéн, ДХМ, фреон 30, хладон 30) — органическое соединение с формулой CH2Cl2, двукратно замещённый галогеналкан, производное метана, прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получение[править | править код]
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении, равном 5:1:
Общая реакция:
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются ректификацией.
Свойства[править | править код]
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С иодом при 200 °C даёт СН2I2, с бромом при 25—30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до HСНО и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан[10].
Применение[править | править код]
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности его используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Также нашёл применение для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, и некоторых других. Ввиду высокой летучести дихлорметана его применение в склеивании полипропилена и полиэтилена ограничено.
Очистка в лаборатории[править | править код]
- Промывают концентрированной серной кислотой, нейтрализуют щёлочью и промывают водой. Сушат над поташом или безводным сульфатом магния и перегоняют. Для дополнительного обезвоживания используют молекулярные сита 4Å[11].
- Кипятят с фосфорным ангидридом с последующей перегонкой. Хранят над молекулярными ситами 3Å.
Специализированные применения[править | править код]
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность[править | править код]
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачнение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать интоксикацию данным веществом.[12]
На крысах показано, что дихлорметан может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³ (по ГОСТ 12.1.005-76), в воде водоёмов не более 7,5 мг/л. Концентрационный предел воспламенения 12—22 %. Не горюч, но поддерживает горение, от огня даёт вспышку, но не горит сам, горит в смеси с другими горящими материалами? внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно? как горючие растворители, скорее как масло[источник не указан 2344 дня].
Примечания[править | править код]
- ↑ Methylene chloride. Дата обращения: 25 ноября 2023. Архивировано 25 ноября 2023 года.
- ↑ European Agreement Concerning the International Carriage of Dangerous Goods by Road: ADR - Applicable As From 1 January 2015 (Two-volume Set) (PDF) : [арх. 22 января 2023]. — New York and Geneva : United Nations, 2014. — Vol. I. — С. 356. — 600 с. — ISBN 978-92-1-056691-9.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ Dichloromethane
- ↑ Метилен хлорид. (недоступная ссылка)
- ↑ name=https://docs.cntd.ru_Меры (недоступная ссылка) безопасности при работе с метиленхлоридом
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. ССБТ. Вредные вещества. Классификация и общие требования безопасности
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0414.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 Трегер Ю. А. Метиленхлорид // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 61. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ Органикум, Т. 2, М. 1992, с. 411.
- ↑ Архивированная копия. Дата обращения: 30 января 2017. Архивировано 9 августа 2017 года.
Литература[править | править код]
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с. — ISBN 5-98371-025-7.
- Ошин Л. А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с. — 8400 экз.